|
Thông báo này được đưa ra dựa trên Công văn số 1444/QLD-CL ngày 29/5/2025 của Cục Quản lý Dược.
Theo Công văn của Cục Quản lý Dược, đơn vị này đã nhận được báo cáo từ Trung tâm Kiểm nghiệm thuốc, mỹ phẩm, thực phẩm Hà Nội (Công văn số 942/KNTMPTP-KHTCKT ngày 27/5/2025) về các mẫu thuốc không đủ điều kiện lưu hành. Các mẫu này được lấy kiểm tra chất lượng vào ngày 12/5/2025 tại Nhà thuốc Đức Anh trực thuộc Công ty TNHH Dược phẩm thiết bị y tế Đức Anh, địa chỉ tại Số 08 đường Huỳnh Thúc Kháng kéo dài, phường Láng Thượng, quận Đống Đa, Hà Nội.
Kết quả kiểm tra cho thấy 07 lô sản phẩm được lấy mẫu tại Nhà thuốc Đức Anh đều không có thông tin số Giấy đăng ký lưu hành và/hoặc số Giấy phép nhập khẩu; cũng như thiếu thông tin cơ sở sản xuất thuốc, cơ sở nhập khẩu thuốc trên nhãn.
Đặc biệt, mẫu thuốc DIAMICRON® MR 60mg (Gliklazid), Số lô: 23F603, Hạn dùng: 04.2026 không chỉ thiếu các thông tin về số đăng ký/giấy phép nhập khẩu, thông tin nhà nhập khẩu và nhãn phụ bằng tiếng Việt, mà còn không đạt yêu cầu chất lượng về chỉ tiêu Định lượng Gliclazid theo Dược điển Việt Nam V. Kết quả định lượng Gliclazid chỉ đạt 42,50 mg (tương ứng 70,83% so với hàm lượng ghi trên nhãn).
Danh sách 07 lô thuốc không có thông tin rõ ràng được nêu trong thông báo bao gồm:
- DIAMICRON® MR 60mg (Gliklazid), Số lô: 23F603, Hạn dùng: 04.2026. (Trên nhãn không in Số đăng ký/số giấy phép nhập khẩu, thông tin nhà nhập khẩu, không có nhãn phụ bằng Tiếng Việt)
- Oseltamivir, Số lô: M1164B01, Ngày sản xuất: 03.2021, Hạn dùng: 03.2023.
- Crestor 20mg (Rosuvastatin), Số lô: A23237030, Hạn dùng: 04.2026.
- Janumet 50/1000mg (Sitagliptin/Metformin), Số lô: 24497505A, Hạn dùng: 07/2026.
- Plavix (Klopidogrel), Số lô: ELB04027, Hạn dùng: 05/2027.
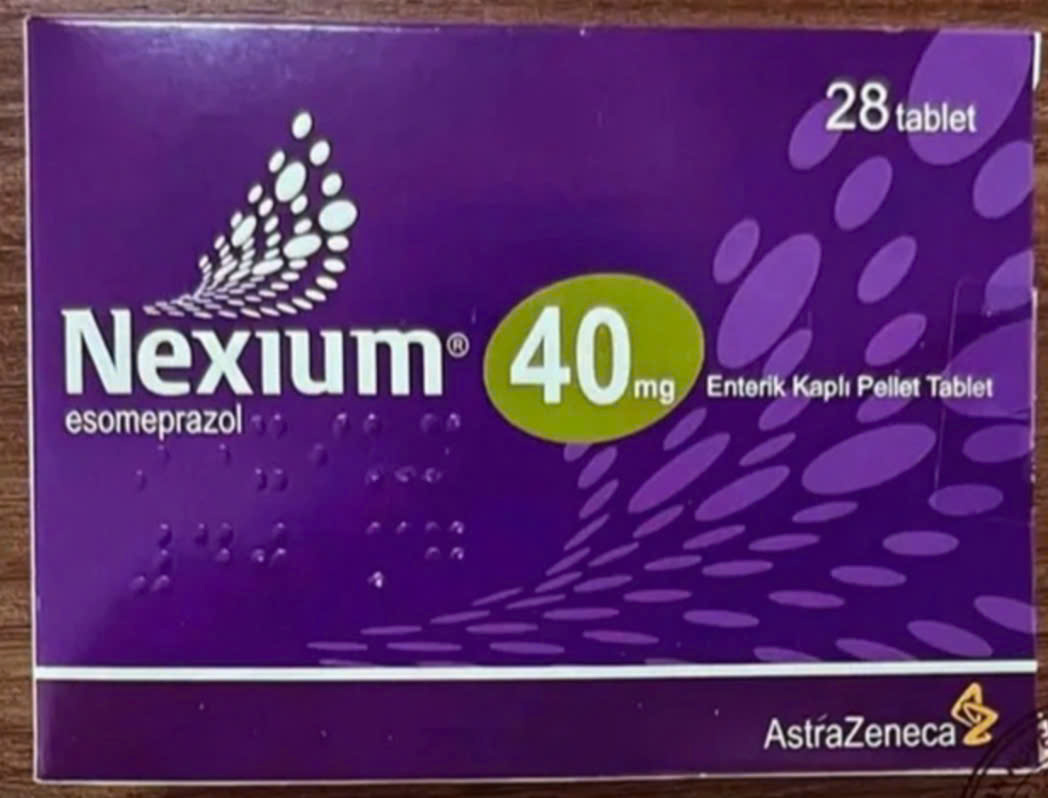
- NEXIUM® 40mg Enterik Kapli Pellet Tablet (Esomeprazol), số lô: 23H420, Hạn dùng: 09.2027. (Trước đó, Cục Quản lý Dược cũng đã thông báo về lô thuốc Nexium 40mg khác nghi ngờ là thuốc giả)
- Crestor 10mg (Rosuvastatin), Số lô: A24236004, Hạn dùng: 07.2027.

Trước tình hình này, Sở Y tế An Giang đề nghị các Văn phòng HĐND & UBND các huyện, thị xã, thành phố; Thủ trưởng các đơn vị y tế trong tỉnh; và Trung tâm Kiểm nghiệm thuốc, mỹ phẩm và thực phẩm tỉnh khẩn trương thực hiện các biện pháp xử lý.
Các đơn vị được yêu cầu truyền thông, thông tin rộng rãi đến các cơ sở buôn bán, sử dụng thuốc và người dân biết để không mua/bán, sử dụng 07 lô sản phẩm nêu trên. Chỉ mua bán thuốc tại các cơ sở kinh doanh dược hợp pháp và không mua/bán thuốc không rõ nguồn gốc, xuất xứ. Đồng thời, kịp thời thông báo các dấu hiệu nghi ngờ về sản xuất, kinh doanh thuốc giả, thuốc không rõ nguồn gốc tới cơ quan y tế và cơ quan chức năng liên quan.
Ngoài ra, Sở Y tế An Giang yêu cầu tăng cường kiểm tra hoạt động kinh doanh của các cơ sở dược trên địa bàn, đặc biệt tập trung kiểm tra đối với 07 lô sản phẩm này. Khi phát hiện, cần tiếp nhận, xác minh thông tin, báo cáo Ban chỉ đạo 389 tỉnh và phối hợp với các cơ quan liên quan để kiểm tra, xác minh, truy tìm nguồn gốc xuất xứ và xử lý nghiêm các trường hợp vi phạm theo quy định. Các kết quả kiểm tra, xử lý cần được báo cáo kịp thời về Sở Y tế An Giang.
Các công ty sản xuất, kinh doanh, nhập khẩu, phân phối có liên quan đến các sản phẩm này được yêu cầu ngừng ngay việc phân phối, lưu hành và thông báo cho các cơ sở đã mua thuốc dừng phân phối, sử dụng và trả về nơi cung ứng. Đồng thời, cung cấp thông tin và phối hợp truy tìm nguồn gốc.
Trung tâm Kiểm nghiệm thuốc, mỹ phẩm và thực phẩm tỉnh An Giang cũng được chỉ đạo tăng cường lấy mẫu, kiểm tra chất lượng thuốc lưu hành trên địa bàn, đặc biệt là các thuốc có nguy cơ bị làm giả hoặc kém chất lượng, và báo cáo kịp thời các vụ việc phát hiện.
Việc phát hiện và xử lý kịp thời các lô thuốc không rõ nguồn gốc và kém chất lượng là rất quan trọng nhằm bảo vệ sức khỏe cộng đồng. Người dân được khuyến cáo chỉ mua thuốc tại các nhà thuốc có uy tín và nguồn gốc rõ ràng.
Nguồn: Công văn số 1849/SYT ngày 30/5/2025 của Sở Y tế An Giang
|
 Tăng cường xử lý tổ chức, cá nhân sản xuất, buôn bán thuốc chữa bệnh và sữa giả
Tăng cường xử lý tổ chức, cá nhân sản xuất, buôn bán thuốc chữa bệnh và sữa giả  [HƯỚNG DẪN] Đăng ký SmartCA từ ứng dụng VNeID
[HƯỚNG DẪN] Đăng ký SmartCA từ ứng dụng VNeID  CHƯƠNG TRÌNH LỄ KỶ NIỆM 70 NĂM NGÀY THẦY THUỐC VIỆT NAM - TTVH NT AN GIANG - VĐ NGỌC PHƯƠNG NAM
CHƯƠNG TRÌNH LỄ KỶ NIỆM 70 NĂM NGÀY THẦY THUỐC VIỆT NAM - TTVH NT AN GIANG - VĐ NGỌC PHƯƠNG NAM  HTV9 | Hội Nghị Đẩy Mạnh Chuyển Đổi Số và Đồng Bộ Dữ Liệu trong Y Tế & Lao Động
HTV9 | Hội Nghị Đẩy Mạnh Chuyển Đổi Số và Đồng Bộ Dữ Liệu trong Y Tế & Lao Động  Dấu ấn công tác y tế 2024: “ĐOÀN KẾT, KỶ CƯƠNG, NÊU GƯƠNG, TRÁCH NHIỆM, HIỆU QUẢ”
Dấu ấn công tác y tế 2024: “ĐOÀN KẾT, KỶ CƯƠNG, NÊU GƯƠNG, TRÁCH NHIỆM, HIỆU QUẢ”  Sức khỏe và cuộc sống (24-10-2024)
Sức khỏe và cuộc sống (24-10-2024)  Tọa đàm Bệnh lý đột quỵ thực trạng tại An Giang và những tiến bộ trong tiếp cận, điều trị hiện nay
Tọa đàm Bệnh lý đột quỵ thực trạng tại An Giang và những tiến bộ trong tiếp cận, điều trị hiện nay  TUẦN LỄ THẾ GIỚI NUÔI CON BẰNG SỮA MẸ (1 – 7/8/2024)
TUẦN LỄ THẾ GIỚI NUÔI CON BẰNG SỮA MẸ (1 – 7/8/2024)  Thông điệp phòng, chống bệnh bạch hầu
Thông điệp phòng, chống bệnh bạch hầu  Những điểm mới trong Luật Khám bệnh, chữa bệnh (sửa đổi) năm 2023
Những điểm mới trong Luật Khám bệnh, chữa bệnh (sửa đổi) năm 2023  Bệnh viện Đa khoa Y học cổ truyền - Phục hồi chức năng tỉnh An Giang
Bệnh viện Đa khoa Y học cổ truyền - Phục hồi chức năng tỉnh An Giang  Cách xử trí người bị say nắng, say nóng
Cách xử trí người bị say nắng, say nóng  Khuyến cáo phòng bệnh ho gà
Khuyến cáo phòng bệnh ho gà  Thông điệp phòng bệnh dại
Thông điệp phòng bệnh dại  AN GIANG: BỆNH VIỆN Y DƯỢC CỔ TRUYỀN - PHỤC HỒI CHỨC NĂNG CHÍNH THỨC HOẠT ĐỘNG
AN GIANG: BỆNH VIỆN Y DƯỢC CỔ TRUYỀN - PHỤC HỒI CHỨC NĂNG CHÍNH THỨC HOẠT ĐỘNG